Hallo Frank,
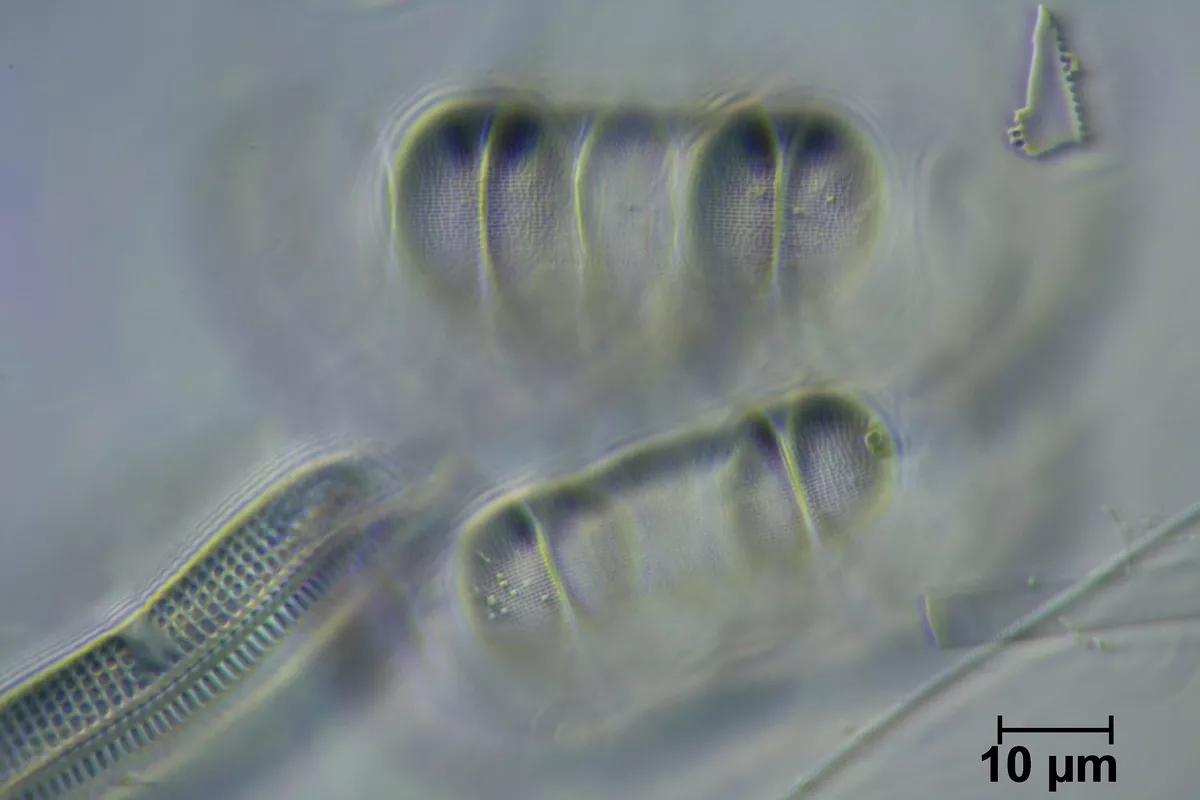
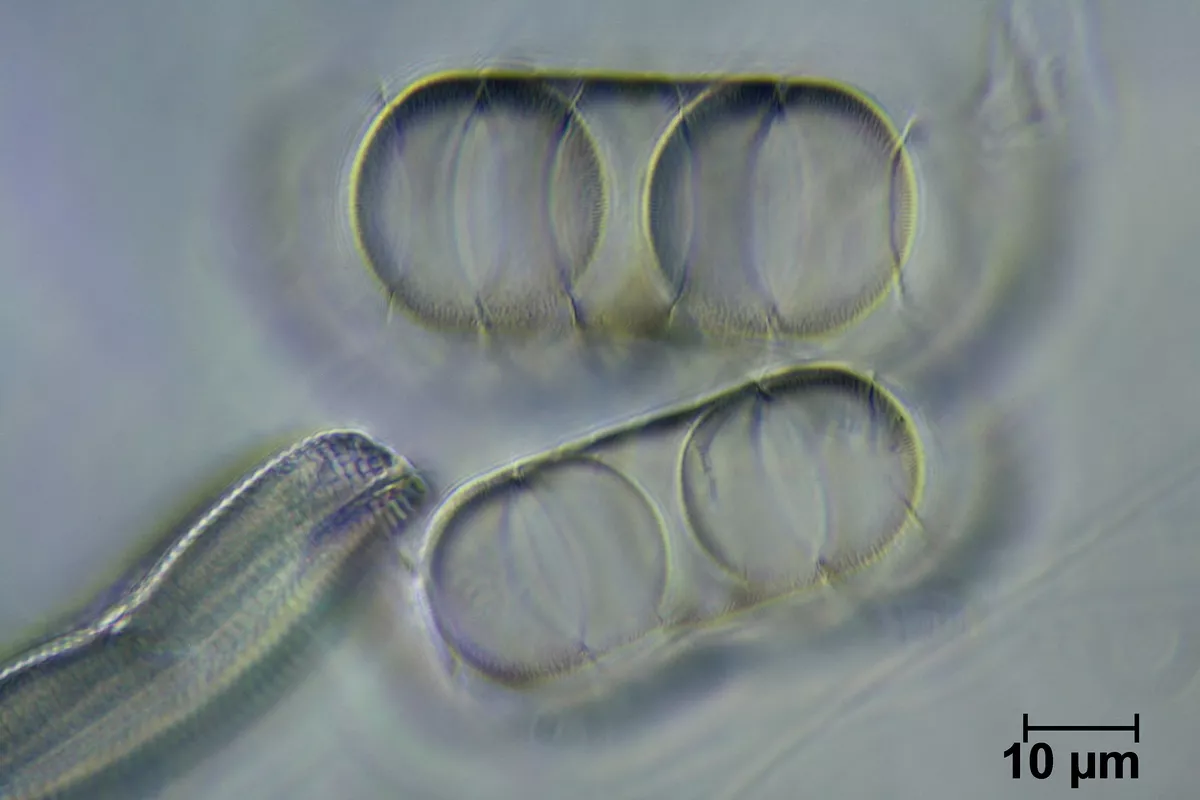
ich habe die Aufnahmen mit dem PL Apo Oel 100/1.32 und Systemkondensor 600, Apl. Oel 1.25 am Leitz Ortholux gemacht.
Viel mehr kann ich da nicht rausholen. Ich stelle den Vergleich noch mal ein. Ich habe heute auch noch probiert, mit dem Heine-Phasenkontrast etwas mehr rauszukitzeln, muss die Aufnahmen noch "unter die Lupe nehmen". Nun bin ich aber auch nicht der beste "Auflöser" , gehe ich mal von einem Lichtmikroskop aus...
, gehe ich mal von einem Lichtmikroskop aus...
Hallo Bernd,
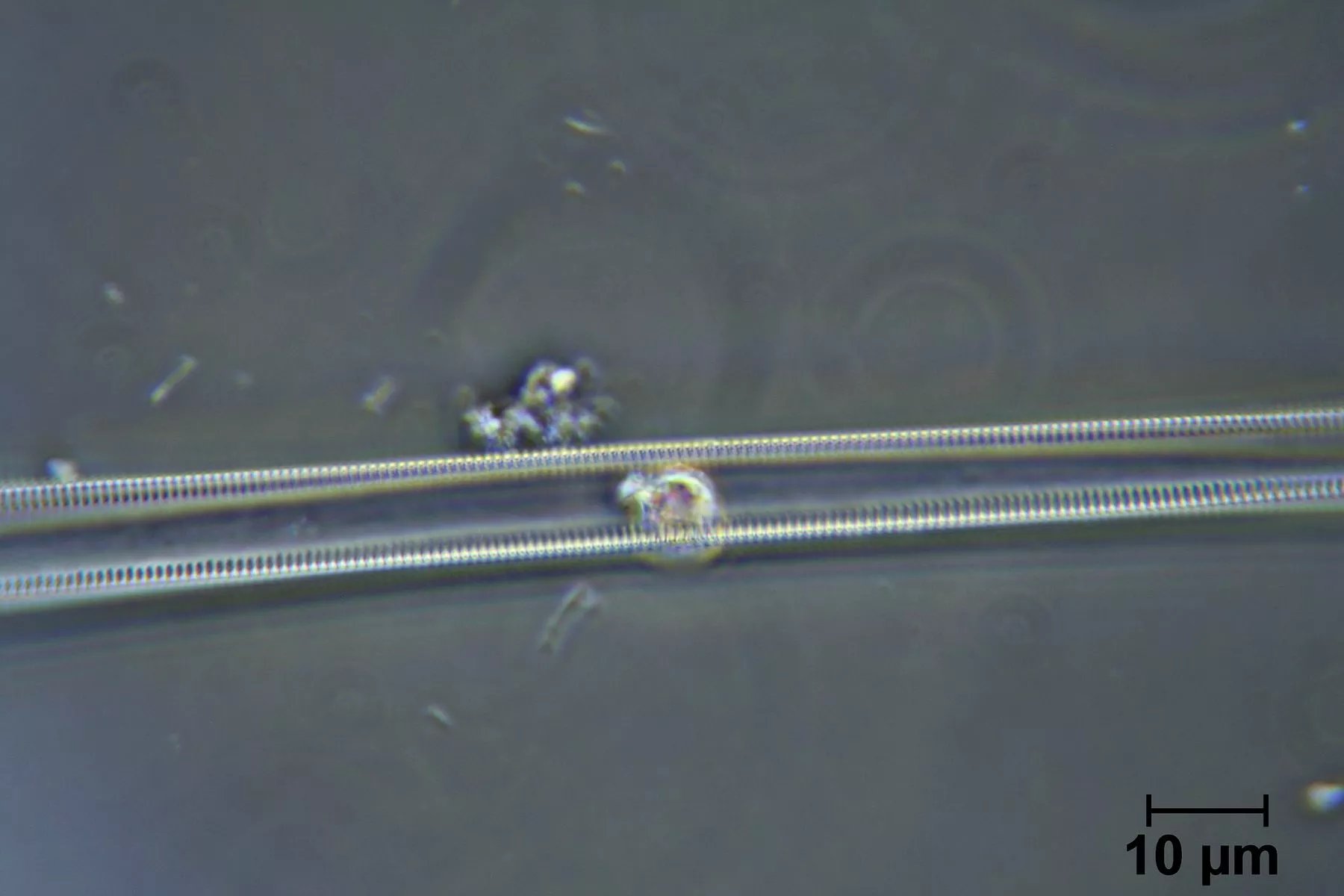
ich habe heute Mittag die dünnen Diatomeen (vielleicht sind das auch nur Teile von Diatomeen) genauer angeschaut... ganz schön klein die Löcher darin. Mit meinem Ortholux sehe ich da nicht viel.

Es gibt welche mit einer Lochreihe und welche mit einer doppelten Reihe von Löchern. Oft scheinen die Teile zusammenzuhängen.

Die Breite der langen Teile liegt bei 2 - 2,5 µm, und der Durchmesser der Löcher bei etwas über 100 nm. Die Löcher sind ca. 160 nm voneinander entfernt.

Gemessen habe ich das bei einer Vergrößerung von 50.000-fach. Das kleine REM liefert, als kleines Tischgerät, dabei nur keine vernüftigen Bilder mehr. Die laute Umluftanlage, Stromkreise, Gebäudeschwingungen und generell die Holztischplatte, das alles wirkt sich störend aus. Allerdings ist das Gerät auch nicht für die hohen Vergrößerungen ausgelegt.
Nur mal als Beispiel, woher ich meine Messwerte bekomme

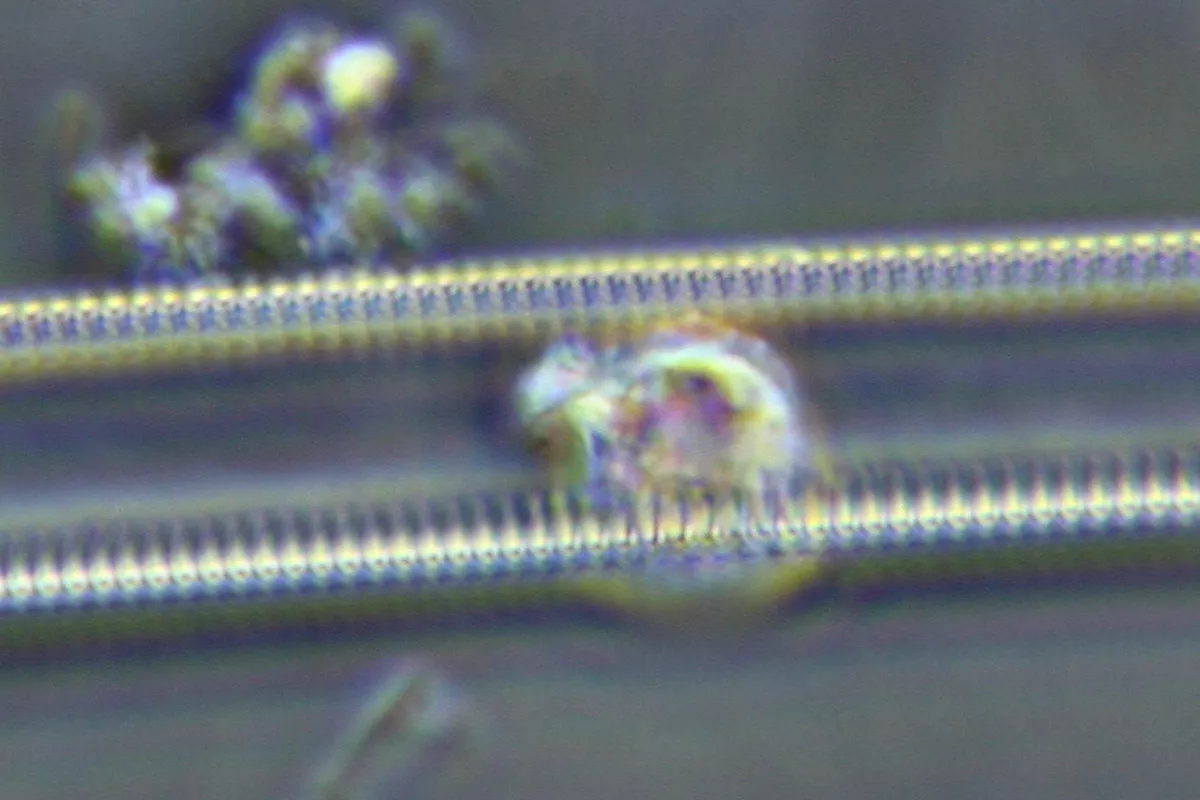
Und dann sind da noch die 2-Reiher

Die Reihen sind ca. 250 nm von einander entfernt die Löcher sind 20- 50 nm größer als bei der einreihigen Diatomee und auch etwas weiter von einander entfernt.
Mit dem Lichtmikroskop habe ich da so meine Schwierigkeiten 
Es sieht eigentlich immer aus wie die 2 links im Bild. Erstaunlicher Weise zeigt das Teil in der Bildmitte eine systematische Struktur. Genaues erkennen kann man aber nicht.

Nun bin ich mal gespannt, ob Du da evtl. schon einen Pfeil im Köcher hast?
Viele Grüße
Detlef
![]()
![]()